背景
ラクダ科動物(ラマ、アルパカ等)はH鎖のみで構成される抗体(重鎖抗体)を有し、その可変領域はVHH(variable domain of heavy chain of heavy chain antibody)抗体と呼ばれます。VHH抗体は温度やpHなどに対し高い安定性を持ち、微生物での低コスト生産も可能です。また、多価抗体や多重特異性抗体、薬物・化合物の修飾など、タンパク質工学的な改変も容易です。これら特長により、様々な分野での応用が期待されているものの、希望とするVHH抗体の取得方法に関しては、多くの課題(免疫する動物の確保や飼育等)が存在します。
当社では、無細胞翻訳系でのディスプレイ法の導入により、ラクダ科動物への免疫を行なわず、特異的なVHH抗体遺伝子を効率的にスクリーニングできるシステムを構築いたしました。得られたVHH抗体遺伝子は、ブレビバチルス発現系にて、効率的に分泌生産させることが可能です。
また本スクリーニングシステムはscFvのような低分子抗体、環状ペプチドなどのフォーマットへの応用も可能です。
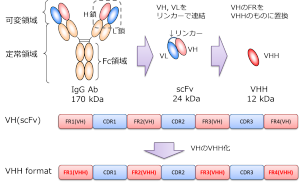
さらに既知のIgGやscFv等のVHの配列から、VHのフレーム領域の配列をVHH抗体のフレーム領域の配列に置き換えることで、VHH化とすることもできます(アプリケーションデータVHH-001参照)。これにより、多価化や検出用酵素との融合など、従来のIgGやscFvよりもタンパク質工学的改変が容易になるというメリットがあります。

VHH抗体はこのような方におすすめします
・安定性の高い抗体を希望される方
・二重特異性化などの高付加価値抗体を検討される方
・低分子抗原や動物種間での相同性の高い抗原に対する抗体をお求めの方
参考資料
1.アプリケーションデータBIPO-002(PDF、2016/5/24追加);プロテインAレジンによるVHH抗体精製
2.アプリケーションデータVHH-001(PDF、2016/12/1追加);scFvからのVHH化、多価化による親和性向上
3.アプリケーションデータVHH-002(PDF、2023/11/8追加);VHH抗体のスクリーニング実施例1(抗VEGF抗体)
図:VH配列からのVHH抗体化模式図
(詳細は弊社技術担当までお問い合わせください;お問い合わせフォーム)
VHH抗体に関する参考文献
1. Naturally occurring antibodies devoid of light chains.
Hamers-Casterman C, Atarhouch T, Muyldermans S, Robinson G, Hamers C, Songa EB, Bendahman N, Hamers R.
Nature. 1993 Jun 3;363(6428):446-8.
2. Nanobodies – from llamas to therapeutic proteins.
Drug Discov Today Technol. 2010 Summer;7(2):e95-e146.
3. Single domain camel antibodies: current status.
Muyldermans S.
J Biotechnol. 2001 Jun;74(4):277-302.
4. Cell-penetrating anti-GFAP VHH and corresponding fluorescent fusion protein VHH-GFP spontaneously cross the blood-brain barrier and specifically recognize astrocytes: application to brain imaging.
Li T, Bourgeois JP, Celli S, Glacial F, Le Sourd AM, Mecheri S, Weksler B, Romero I, Couraud PO, Rougeon F, Lafaye P.
FASEB J. 2012 Oct;26(10):3969-79.
5. Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonal antibodies.
van der Linden RH, Frenken LG, de Geus B, Harmsen MM, Ruuls RC, Stok W, de Ron L, Wilson S, Davis P, Verrips CT.
Biochim Biophys Acta. 1999 Apr 12;1431(1):37-46.
6. Anti-survivin single-domain antibodies derived from an artificial library including three synthetic random regions by in vitro selection using cDNA display.
Suzuki T, Mochizuki Y, Kimura S, Akazawa-Ogawa Y, Hagihara Y, Nemoto N.
Biochem Biophys Res Commun. 2018 Sep 10;503(3):2054-2060